PROPIEDADES DE LOS ELEMENTOS QUÍMICOS
Indicador de logro: Reconoce e interpreta las propiedades de los elementos químicos.
Competencia: Reconozco e interpreto las propiedades de los elementos químicos.
Pregunta generadora:
Por el número atómico y su símbolo los elementos ocupan un lugar bien
definido en la tabla periódica. Foto Ciencias naturales al día. Wordpress.com
Indicador de logro: Reconoce e interpreta las propiedades de los elementos químicos.
Palabras claves: ionización, radio atómico, afinidad eléctrica, electronegatividad, núcleo, orbital, átomo, energía, número atómico, molécula, ión, anión.
Pregunta generadora:
¿Por qué es importante reconocer e interpretar las propiedades de los elementos químicos?
Situación de aprendizaje:
Entre otras propiedades sobresalen el radio atómico, potencial de ionización, la afinidad eléctrica y la electronegatividad.
Variación de algunas propiedades periódicas de los elementos químicos
Material de apoyo:
1. SWF,http://www.virtual.unal.edu.co/cursos/ciencias/mtria_ensenanza/tabla_periodica/flash/4_01.swf.
2. http://www.periodicvideos.com/videos/016.htm
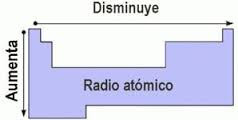
1. El radio atómico es la distancia que existe entre el núcleo y el orbital más externo de un átomo. Poe medio del radio atómico, es posible determinar el tamaño del átomo.
Gráfico correspondiente a la propiedad del radio
atómico. Foto monografías.com
En un grupo cualquiera de la tabla periódica, los elementos químicos aumentan su valor de arriba a abajo con la cantidad de energía. Al tener mayor el nivel de energía, el radio atómico es mayor.
Mientras tanto en los periodos, los elementos químicos su radio atómico aumenta de derecha a izquierda, por cuanto al ir hacia la derecha, el número atómico (Z) aumenta en una unidad de un elemento a otro, es decir hay un aumento de carga nuclear por lo que los electrones son atraídos más fuertemente hacia el núcleo disminuyendo así el radio atómico.
El radio atómico puede ser covalente o metálico. La distancia entre núcleos de átomos vecinos en una molécula es la suma de sus radios covalentes, mientras que el radio metálico es la mitad de la distancia entre núcleos de átomos vecinos en cristales metálicos.
Recursos de apoyo:
1. https://www.youtube.com/watch?v=PBt20ZKOkk0
2. https://www.youtube.com/watch?v=VCLwzkjml6E
2. La electronegatividad según Linus Pauling es la capacidad de un elemento para atraer hacia sí los electrones de otro átomo para formar un enlace químico. La electronegatividad disminuye de arriba hacia abajo y en los períodos aumenta de izquierda a derecha.
La electronegatividad disminuye de arriba hacia mientras que en
los periodos aumenta de izquierda a derecha. Slideplayer.com
El elemento químico flúor (F) es el que tiene mayor electronegatividad, mientras que el francio (Fr) es el elemento con menos electronegatividad.
La electronegatividad de los elementos representativos siguen cierto patrón dentro de la tabla periódica como puede verse en la gráfica anterior, donde el tono de color se ha incrementado a medida que sube la electronegatividad: observe que la magnitud crece desde la esquina inferior izquierda hacia la superior derecha, observe también que no se ha asignado electronegatividad a los gases nobles ya que estos ni ceden ni atraen electrones.
Los metales son de baja electronegatividad por lo que tienden a regalar electrones para formar iones positivos, y los no metales son más electronegativos, por eso forman iones negativos.
La electronegatividad es muy útil para conocer el tipo de enlace que originarán dos átomos en su unión.
Recursos de apoyo:
1. Elementos ordenados por su electronegatividad según Pauling:
http://www.lenntech.es/tabla-peiodica/electronegatividad.htm
2. La electronegatividad: https://www.youtube.com/watch?v=eCU8mzdISO4
3. Potencial de ionización. Es llamado también energía de ionización y se define como la energía que necesita para separar un electrón del último nivel de energía de un átomo. El átomo queda con carga eléctrica positiva, y recibe el nombre de ion positivo o catión. La energía de ionización aumenta en los períodos de izquierda a derecha, como consecuencia del aumento del número atómico y del número de electrones en el último nivel.
La energía de ionización aumenta en los periodos de izquierda a derecha,
por el aumento del número atómico y del número de electrones.
Gráfico aprendotodoslosdías.blogspot.
Por ejemplo, el bromo (Br) presenta un mayor potencial de ionización que el potasio (K). Dentro de los grupos, el potencial de ionización disminuye de arriba hacia abajo por ser mayor la distancia entre el núcleo y los electrones periféricos. El cesio (Cs) tiene un potencial de ionización menor que el litio (Li). Aunque tienen el mismo número de electrones en el último nivel, el del cesio se encuentra más alejado de la influencia del núcleo que el del litio.
Recurso de apoyo: https://www.youtube.com/watch?v=6SrmX3pldSk
4. Afinidad electrónica. Se define como la cantidad de energía que se libera cuando un átomo gana un electrón. Cuando el aporte de este electrón se realiza sobre un átomo neutro, se convierte en un ion negativo o anión.
Gráfico correspondiente a la afinidad electrónica. Slideshare.
La afinidad electrónica se hace más negativa de izquierda a derecha en los periodos, a medida que aumenta el número atómico, y de abajo hacia arriba en los grupos al disminuir el número atómico. Por ejemplo, el cloro (Cl), tiene un valor de afinidad electrónica más negativo que el magnesio (Mg).
Los no metales tiene afinidades electrónicas más bajas que los metales, exceptuando los gases nobles que presentan valores positivos por su estabilidad química, ya que la afinidad electrónica está influida por la regla del octeto.
Los elementos químicos del grupo 1, tienden a ganar un electrón y formar aniones -1, completando el subnivel S, mientras que los elementos del grupo 2, que la lo tiene completo, no presentan esa tendencia. Análogamente sucede en el bloque P, donde las afinidades electrónicas se van haciendo más negativas a medida que nos acercamos a los gases nobles.
Recursos de apoyo:
1. https://www.youtube.com/watch?v=FTVV6F0i_F4
2. http://www.educaplus.org/sp2002/index.html
3. http://ntic.educacion.es/w3//eos/MaterialesEducativos/mem2000/tablap/index.htm
Para entretenernos un ratito y sacar conclusiones:
http://www3.gobiernodecanarias.org/medusa/lentiscal/1-CDQuimica-TIC/FlashQ/1-Estructura%20A/electronegatividad.swf
Lectura motivacional:
Una fiesta muy elemental: http://studylib.es/doc/261415/una-fiesta-muy-elemental-file
Vídeos de refuerzo:
1. https://www.youtube.com/watch?v=O8uXEhdSwOA
2. https://www.youtube.com/watch?v=3I3hoC4lOPM&nohtml5=False
Bibliografía
* Santillana 7 ISBN 958-24-1081-7
* SWF,http://www.virtual.unal.edu.co/cursos/ciencias/mtria_ensenanza/tabla_periodica/flash/4_01.swf
* https://www.youtube.com/watch?v=VCLwzkjml6E
* https://www.youtube.com/watch?v=eCU8mzdISO4
* http://www.educaplus.org/sp2002/index.html
* http://ntic.educacion.es/w3//eos/MaterialesEducativos/mem2000/tablap/index.htm
* http://www.periodicvideos.com/videos/016.htm






No hay comentarios:
Publicar un comentario